Case quantique
En physique, en mécanique quantique, dans le modèle de Bohr, les cases quantiques sont les places dans les orbitales atomiques qui peuvent être occupées par un électron, ou par une paire d'électrons de spin complémentaires.
Recherche sur Google Images :

Source image : www.sur-la-toile.com Cette image est un résultat de recherche de Google Image. Elle est peut-être réduite par rapport à l'originale et/ou protégée par des droits d'auteur. |
Page(s) en rapport avec ce sujet :
- Le nombre quantique m² sert à désigner la case quantique de l'électron. Ce n'est pas un lieu précis mais... La case quantique dépend des nombres n, l, et m².... (source : cea)
- toute case quantique est saturée à 2 e. -., de spin opposés ou anti- parallèles. •. : électrons appariés (=1/2, . = -1/2). •. : électron célibataire.... (source : wikinsa)
En physique, en mécanique quantique, dans le modèle de Bohr, les cases quantiques sont les places dans les orbitales atomiques qui peuvent être occupées par un électron, ou par une paire d'électrons de spin complémentaires.
Nombres quantiques
Le nuage électronique de chaque atome peut être défini par quatre nombres dits «quantiques», dans la mesure où ils ne prennent que certaines valeurs quantifiées :
- n : nombre quantique «principal» qui peut prendre l'ensemble des valeurs entières identiques ou supérieures à 1 soit 1, 2, 3, 4… Il définit en grande partie l'énergie de l'électron mais aussi la taille de l'orbitale qui augmente à mesure que n augmente.
- l : nombre quantique «secondaire» qui peut prendre l'ensemble des valeurs entières comprises entre 0 et n-1. Si n = 2, l peut être identique à 0 ou à 1. Ce nombre définit essentiellement la forme de l'orbitale. Avec l = 0 la forme est sphérique, avec 1 une forme bilobée, l = 2 forme ayant 4 lobes, l = 3 huit lobes et ainsi de suite. Il aide aussi à déterminer l'énergie de l'électron et sa distance moyenne au noyau.
- ml (ou m) : nombre quantique «magnétique» qui peut prendre l'ensemble des valeurs entières comprises entre -l et +l, il définit l'orientation de l'orbitale décrite par l'électron. Plus l est élevé, plus il y a d'orientations différentes envisageables pour cette orbitale.
- ms (ou s) : nombre quantique de «spin» qui représente le spin de l'électron, à savoir +1/2 ou -1/2. Il est indépendant des autres nombres quantiques. On peut classiquement l'interpréter comme un «moment cinétique intrinsèque.» Il représente en réalité plutôt la symétrie du fermion.
En fonction des nombres quantiques auxquels on a accès, on peut définir plus ou moins exactement une partie de ce nuage :
- Si les 4 nombres quantiques sont connus, l'état permis de l'électron est défini ;
- Si les 3 premiers nombres quantiques sont connus, alors l'orbitale de l'électron est définie.
Pour désigner plus aisément une orbitale ou un état de l'électron, une notation symbolique est utilisée. Le nombre principal n est désigné par un chiffre, l par une lettre et la valeur de m est en indice. Le spin est noté par un tiret pour la valeur -1/2, et rien pour la valeur +1/2.
- «s» pour l = 0 (sharp)
- «p» pour l = 1 (principal)
- «d» pour l = 2 (diffuse)
- «f» pour l = 3 (essentiel)
- …
Par exemple :
- 4f − 2 veut dire n = 4, l = 3, ml = -2, ms = +1/2 ;
- 2p + 1 veut dire n = 2, l = 1, ml' = +1, ms = +1/2.
Influence du numéro atomique sur l'énergie
Plus l'électron occupe une orbitale basse, comme l'orbitale 1s, principale, plus l'énergie qu'il contient est faible. La taille d'une orbitale dépend énormément de son énergie.
Pour l'hydrogène, l'énergie correspond uniquement au nombre quantique n. Pour cet atome, et uniquement lui, la formule de l'énergie apportée par la mécanique quantique est précisément la même que celle du modèle de Bohr, soit (en eV) :
La valeur -13, 6 eV, qui correspond à l'état essentiel de l'hydrogène, est la constante de Rydberg. On peut étendre ce modèle aux ions dits «hydrogénoïde» (ne possédant qu'un seul électron) :
Pour les autres atomes, l'énergie des électrons dépend de n et de l (pas de ml ni de ms). La règle de Klechkowski est utilisée pour la déterminer - mais il existe de nombreuses exceptions. En réalité, elle sert à savoir quel électron a plus d'énergie que les précédents. Pour l'hydrogène, le niveau d'énergie 2s = 2p mais pour l'hélium 2s < 2p à cause de l.
Plus un atome possède de protons, plus les électrons sont complexes à «enlever» c'est-à-dire moins ils possèdent d'énergie. Ainsi le niveau d'énergie de l'hydrogène 1s est particulièrement supérieur au niveau d'énergie 1s de l'hélium, tandis qu'avec les mêmes atomes, le niveau 2s est environ au même niveau (en réalité, légèrement plus bas). Plus il y a de protons, plus les tailles des orbitales diminuent.
Configuration électronique à l'état essentiel
Le principe d'exclusion de Pauli décrit que dans un même atome, deux électrons ne peuvent posséder leurs quatre nombres quantiques semblables ; n, l et ml définissent une «case quantique» (les deux valeurs envisageables de ms définissent une orientation de l'électron). Chaque case quantique peut contenir 0, 1 électron (de spin up) ou 2 électrons (de spins opposés).
C'est la première règle de l'«Aufbau Prinzip» : l'atomistique.
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 12/04/2009.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.

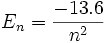
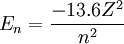

 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité