Hybridation
En chimie, l'hybridation des orbitales atomiques est le mélange des orbitales atomiques d'un atome appartenant à la même couche électronique de façon à former de nouvelles orbitales qui permettent mieux de décrire qualitativement les liaisons entre atomes.
Recherche sur Google Images :
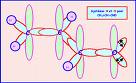
Source image : personnel.univ-reunion.fr Cette image est un résultat de recherche de Google Image. Elle est peut-être réduite par rapport à l'originale et/ou protégée par des droits d'auteur. |
Page(s) en rapport avec ce sujet :
- 9 messages - 7 auteurs - Dernier message : 9 nov 2003 je ne comprends pas de quelle manière une orbitale hybride peut former une... à une combinaison linéaire des orbitales atomiques des atomes... L'objectif de l'hybridation est de pouvoir construire la molécule plus... en fait l'hybridation différencie le type des liaisons PI (faible et sigma)... (source : forums.futura-sciences)
- On peut développer une théorie de la liaison chimique sans hybrider les orbitales atomiques, en ne considérant que les attractions et les répulsions... (source : books.google)
En chimie, l'hybridation des orbitales atomiques est le mélange des orbitales atomiques d'un atome appartenant à la même couche électronique de façon à former de nouvelles orbitales qui permettent mieux de décrire qualitativement les liaisons entre atomes. Les orbitales hybrides sont particulièrement utiles pour expliquer la forme des orbitales moléculaires des molécules. L'hybridation des orbitales atomiques fait aussi partie intégrante de la théorie VSEPR (Valence Shell Electronic Pairs Repulsion).
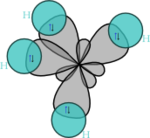
Exemple du méthane
La théorie des orbitales hybrides a été développée par Linus Pauling pour expliquer la géométrie de molécules comme le méthane (CH4). La difficulté de compréhension de cette dernière a pour cause les raisons suivantes.
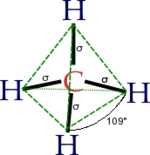
Il s'agit d'une molécule constituée d'un atome de carbone lié à quatre atomes d'hydrogène. La configuration électronique du carbone dans son état essentiel est 1s² 2s² 2px¹ 2py¹, ou
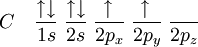
(l'orbitale atomique 1s est plus basse en énergie que l'orbitale 2s, cette dernière étant elle-même plus basse en énergie que les orbitales 2p).
De prime abord, il semblerait que l'atome de carbone ne doive former que deux liaisons covalentes du fait de l'existence de deux orbitales 2p à moitié remplies. Cependant, CH2 ou méthylène n'existe pas comme tel mais seulement comme groupement au sein de molécules. Ce raisonnement ne permet pas d'expliquer l'existence du méthane.
D'autre part un raisonnement impliquant un état excité ne permettrait pas d'expliquer les propriétés du méthane. Si un électron de l'orbitale 2s est excité et occupe l'orbitale 2pz, le carbone peut alors être lié à quatre atomes d'hydrogène (4 orbitales du carbone sont à moitié remplies). Cependant, la forme des orbitales 2s et 2p étant particulièrement différentes, le recouvrement avec les orbitales des différents atomes d'hydrogène sera différent, et les quatre liaisons C-H n'auront pas la même énergie ce qui est contraire aux résultats expérimentaux.
L'hybridation
Une manière de répondre au problème de l'existence et de la géométrie de ce type de molécule est l'hybridation des orbitales atomiques. Historiquement, ce concept est apparu pour expliquer les liaisons chimiques dans des dispositifs particulièrement simples (comme le méthane). Il s'est avéré ensuite que cette théorie est applicable plus largementet elle fait actuellement partie des bases de la compréhension de la chimie organique. Elle est moins aisément applicable aux branches de la chimie pour lesquelles sont mis en jeu des atomes lourds. La théorie de l'hybridation pour la chimie des éléments de transition est plus compliquée et conduit à des résultats nettement moins précis.
Les orbitales (orbitales atomiques, orbitales hybrides ou orbitales moléculaires) forment un modèle représentant la manière dont les électrons se comportent autour des noyaux atomiques. Dans le cas de l'hybridation, le modèle est basé sur les orbitales atomiques de l'hydrogène. Les orbitales hybrides sont des mélanges de ces orbitales atomiques où elles se recouvrent en différentes proportions. Les orbitales atomiques utilisées comme base sont celles de l'hydrogène car il s'agit de l'un des seuls cas pour lesquels il est envisageable de résoudre précisément l'équation de Schrödinger. Les orbitales obtenues sont alors un peu déformées dans les atomes plus lourds comme le carbone, l'azote et l'oxygène.
La première étape dans la construction des orbitales hybrides est l'excitation d'un (ou plusieurs) électron (s). Pour simplifier, la suite du texte traite surtout de l'exemple de la molécule de méthane. Le proton constituant le noyau d'un atome d'hydrogène attire l'un des électrons de valence du carbone. Ce dernier occupe alors un état excité, avec un électron 2s occupant une orbitale 2p. En conséquence, l'influence du noyau de l'atome de carbone sur les électrons de valence augmente du fait de l'augmentation de la charge effective (charge effectivement ressentie par les électrons : elle est identique à la charge du noyau diminuée de l'écrantage causé par les autres électrons). La combinaison de ces forces (attraction par le noyau d'hydrogène et modification de l'attraction par le noyau de carbone) conduit à de nouvelles fonctions mathématiques, les orbitales hybrides. Dans le cas de l'atome de carbone lié à quatre atomes d'hydrogène, il se crée quatre nouvelles orbitales : l'orbitale 2s se mélange avec les trois orbitales 2p pour former quatre orbitales hybrides sp3 :
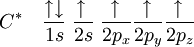 devient
devient 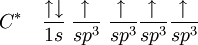
Dans CH4, ces quatre orbitales sp3 se recouvrent avec les quatre orbitales 1s des quatre atomes d'hydrogène ce qui conduit à la formation de quatre liaisons sigma. Ces quatre liaisons ont la même longueur et la même énergie, ce qui est conforme aux résultats expérimentaux.
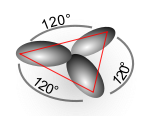
La structure des autres molécules organiques s'explique de manière identique. Par exemple dans l'éthylène, les orbitales atomiques du carbone se mélangent pour former des orbitales hybrides sp2, et le recouvrement entre les atomes de carbone et avec ceux d'hydrogène conduit à la formation de trois liaisons C-H de type sigma ainsi qu'à une double liaison C-C (liaison de type σ -recouvrement axial- juxtaposée par une liaison de type π -recouvrement lateral-.
La proportion de caractère p n'est pas restreinte à des valeurs entières, et il existe par exemple des orbitales hybrides sp2.5. Dans ce cas, la géométrie est déformée comparé aux orbitales hybrides "idéales". Selon la règle de Bent, le caractère p d'une liaison est d'autant plus grand qu'elle est dirigée vers un élément plus électronégatif.
Forme des molécules
Alliée à la théorie VSEPR, l'hybridation des orbitales permet d'expliquer qualitativement la géométrie des molécules :
| Orbitales hybrides | Géométrie | type de molécule | |
|---|---|---|---|
| sp | linéaire | AX2 (ex : BeCl2) | |
| sp2 | trigonale | AX3 (ex : BCl3, graphite) | |
| sp3 | tétraèdrique | AX4 (ex : CH4) | |
| sp3d | bipyramide trigonale | AX5 (ex : PCl5) | |
| sp3d2 | octaèdrique | AX6 (ex : SF6) ; AX5E (ex :ClF5) | |
| dsp2 | plan-carré | (ex : complexe du cuivre) |
Ces exemples sont valables quand l'atome central ne porte pas en plus une paire d'électrons. Si tel est le cas, celle-ci est décompté avec Xi mais les angles de liaisons sont différents. C'est le cas par exemple pour la molécule d'eau H2O : la géométrie est bien tétraèdrique (en prenant en compte les doublets électroniques), mais le tétraèdre est déformé (angle HOH de 104, 5 degrés).
De telles déformations (de quelques degrés uniquement) sont anecdotiques et la forme générale des polyèdres réguliers peut être retenue.
Au delà des dispositifs de type AX4, autrement dit au delà de l'hybridation sp3, on voit naitre des orbitales d dont la participation à la liaison est particulièrement controversée, et pour le moins délicate à expliquer. En réalité, on peut particulièrement bien construire les orbitales moléculaires d'une bipyramide trigonale sans avoir recours aux orbitales d. Mieux, les méthodes quantiques amènent à PCl5 en bipyramide trigonale alors même qu'aucune orbitale d ne figure dans le calcul.
Les qualifier d'idéalement inutiles est probablement légèrement exagéré, mais ces hybridations sp3d ou sp3d2 et dsp2 ne peuvent avoir en tous cas qu'un rôle particulièrement marginal dans notre compréhension de la chimie : Ces dispositifs sont bien mieux décris par la théorie des Orbitales Moléculaires délocalisées.
Références
- (en) L. Pauling, J. Am. Chem. Soc. 53 (1931), 1367
- (en) L. Pauling, The Nature of the Chemical Bond, Cornell University Press (ISBN 0801403332)
- (en) Clayden, Greeves, Warren, Wothers. Organic Chemistry. Oxford University Press (2001), ISBN 0198503466.
- (en) Cet article est partiellement ou en totalité issu d'une traduction de l'article de Wikipédia en anglais intitulé «Orbital hybridisation».
- (en) H. A. Bent, Chem. Rev. ; 68 (1968), 587-648.
Voir aussi
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 13/04/2009.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.


 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité