Liaison covalente de coordination
Une liaison covalente de coordination est une description de la liaison covalente entre deux atomes pour lesquels les deux électrons partagés dans la liaison proviennent du même atome.
Recherche sur Google Images :
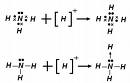
Source image : fr.wikipedia.org Cette image est un résultat de recherche de Google Image. Elle est peut-être réduite par rapport à l'originale et/ou protégée par des droits d'auteur. |
Page(s) en rapport avec ce sujet :
- c) Réseaux de coordination : On voit émerger actuellement de nouvelles.... a) Liaison s à 3 électrons : Il est établi que certains composés du type diamine... (source : www-chimie.u-strasbg)
- C'est Gilbert Lewis qui a introduit le principe de la liaison covalente en ... d'une liaison covalente au sens courant du terme ; soit les deux électrons... de liaison de coordinence, ou de coordination ou encore de liaison dative.... (source : fr.encarta.msn)
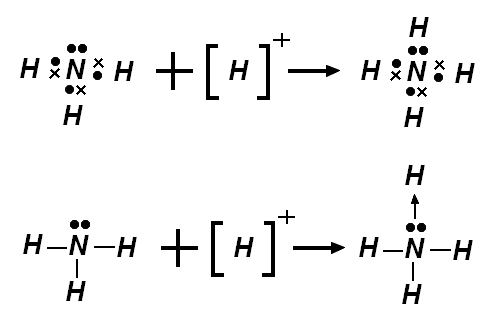
Une liaison covalente de coordination (anciennement connue sous le nom de liaison dative, désormais obsolète[1]) est une description de la liaison covalente entre deux atomes pour lesquels les deux électrons partagés dans la liaison proviennent du même atome. La distinction comparé à une liaison covalente ordinaire est artificielle, mais la terminologie est fréquente dans les manuels, et tout spécifiquement ceux traitant des composés de coordination. Une fois les liaisons constituées par ce biais, sa force et sa description n'est pas différente des autres liaisons polaires.
Les liaisons covalentes de coordination sont évoquées quand une base de Lewis (donneur d'électrons) apporte une paire d'électrons à un acide de Lewis (accepteur d'électrons) pour donner un adduit. Le processus de formation d'une liaison dative est nommé coordination. Le donneur d'électrons prend une charge positive, l'accepteur d'électrons acquérant dans le même temps une charge formelle négative.
Exemples
De manière classique, tout composé contenant une paire d'électrons non appariés peut former une liaison de coordination. La liaison dans divers composés chimiques peut être décrite comme une liaison covalente de coordination.
- le monoxyde de carbone (CO) peut être reconnu comme présentant une liaison de coordination et deux liaisons covalentes «normales» entre les atomes de carbone et d'oxygène. Cette description particulièrement inhabituelle illustre la flexibilité de ce type de description. Ainsi dans le CO, le carbone est l'accepteur d'électron et l'oxygène le donneur d'électron.
- l'ion ammonium (NH4+), peut être perçu comme comprenant quatre liaisons covalentes de coordination entre les protons (ions H+) et le trianion azote N3-.
- le dichlorure de béryllium (BeCl2) est décrit comme déficitaire en électrons dans le sens où les espèces triatomiques (qui existent en phase gazeuse) entourent les centres Be avec quatre électrons de valence. Quand ils sont traités par du chlore en excès, les ions Be2+ se lient avec quatre ions chlorure pour former l'anion tétrachlorobéryllate, BeCl42-, dans lequel l'ensemble des ions respectent la règle de l'octet pour les électrons.
Composés de coordination
La notion de liaison de coordination est fréquemment utilisée pour décrire les complexes de coordination, et spécifiquement ceux impliquant des ions métalliques. Dans de tels complexes, plusieurs bases de Lewis donnent leurs paires d'électrons «libres» à un autre cation métallique dépourvu, qui agit comme un acide de Lewis et accepte par conséquent les électrons. Des liaisons de coordination se forment et le composé résultant est nommé «complexe de coordination», et les donneurs d'électrons sont nommés ligands. Une description plus utile de la liaison dans les composés de coordination est apportée par la théorie du champ de ligands, qui traite des orbitales moléculaires pour la description des liaisons dans de tels composés polyatomiques.
De nombreux composés chimiques peuvent servir de ligands, comme ceux contenant des ions oxygène, soufre, azote et halogènes. Le ligand le plus commun est l'eau (H2O, ligand aqua), qui forme des complexes de coordination avec des ions métalliques (comme l'ion hexaaquacuivre (II), [Cu (H2O) 6]2+). L'ammoniaque (NH3) (ligand ammine, dans ce contexte) est aussi un ligand commun, comme certains anions, particulièrement les ions fluorure (F-), chlorure (Cl-), cyanure (CN-), mais aussi des molécules neutres tels le monoxyde de carbone (CO) et les phosphines (PR3).
Références
- ↑ (en) Mondial Union of Pure and Applied Chemistry. «dative bond». Compendium of Chemical Terminology Internet edition.
- (en) Cet article est partiellement ou en totalité issu d'une traduction de l'article de Wikipédia en anglais intitulé «Coordinate covalent bond».
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 13/04/2009.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.


 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité