Atoms in Molecules
L'approche Atoms in Molecules ou Atoms-in-Molecules ou encore théorie quantique des atomes dans les molécules est un modèle de chimie quantique caractérisant la liaison chimique d'un dispositif en se basant sur une approche topologique de la densité de charge.
Recherche sur Google Images :

Source image : phys.chem.ntnu.no Cette image est un résultat de recherche de Google Image. Elle est peut-être réduite par rapport à l'originale et/ou protégée par des droits d'auteur. |
Page(s) en rapport avec ce sujet :
- liaison de valence : liaison chimique intramoléculaire, qui lie les atomes entre eux au sein d'une molécule, comme par exemple les atomes d'hydrogène (H) et ... (source : cnrs)
- La molécule d'eau (H2O) contient 2 atomes d'hydrogène et 1 atome d'oxygène..... de liaisons chimiques qu'un atome peut avoir avec les atomes d'autres... (source : positron-libre)
- La liaison hydrogène n'a qu'un dixième de la force d'une liaison covalente.... On le voit, la grande majorité des liaisons entre atomes et molécules sont ... (source : lefigaro)
L'approche Atoms in Molecules (AIM) ou Atoms-in-Molecules ou encore théorie quantique des atomes dans les molécules (en anglais Quantum Theory of Atoms in Molecules, QTAIM) est un modèle de chimie quantique caractérisant la liaison chimique d'un dispositif en se basant sur une approche topologique de la densité de charge. En plus de la liaison, l'AIM permet le calcul de certaines propriétés physiques sur une base par atome, en divisant l'espace en volumes atomiques contenant chacun précisément un noyau. Développée par le professeur Richard Bader dès le début des années 60, elle est devenue progressivement dans les dernières décennies une théorie pour proposer des réponses à certaines questions sur les dispositifs chimiques, dans de nombreux cas difficilement tractables par d'autres modèles ou théories en chimie[1]. En QTAIM, un atome est défini comme un dispositif propre ouvert, c'est-à-dire un dispositif pouvant transporter de l'énergie et de la densité électronique, qui est situé dans l'espace tridimensionnel. Chaque atome agit comme un attracteur local de la densité électronique, et peut ainsi être défini en termes de courbures locales de la densité électronique. L'étude mathématique de ces comportements est référée dans la littérature comme «topologie de densité de charge». Cependant, le terme de topologie est utilisé dans un sens différent que celui des mathématiques.
Résultats principaux
Les principales constats de l'approche AIM sont :
- une molécule peut être divisée de manière unique en un ensemble de volumes atomiques. Ces volumes sont scindés par une série de surfaces au travers desquelles le champ vectoriel du gradient de densité électronique n'a pas de flux :
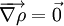 . Les propriétés atomiques comme la charge atomique, le moment dipôlaire et les énergies peuvent être calculées en intégrant les opérateurs correspondants sur le volume atomique.
. Les propriétés atomiques comme la charge atomique, le moment dipôlaire et les énergies peuvent être calculées en intégrant les opérateurs correspondants sur le volume atomique. - deux atomes sont liés si leurs volumes atomiques possèdent une interface interatomique commune, et qu'il existe un point critique (3, −1) sur cette surface. Un point critique est défini comme un point de l'espace où le gradient est nul. Un point critique (3, −1) est défini comme un point critique auquel deux des valeurs propres de la matrice hessienne pour ce point sont négatives et la densité électronique est un maximum comparé à la ligne de voisinage. Au long du chemin viriel associé, l'énergie potentielle est maximalement stabilisée.
- les liaisons interatomiques sont classés soit comme confinée ou apportée, selon que le laplacien de la densité électronique au point critique soit positif ou négatif, respectivement.
- la tension géométrique de la liaison peut être évaluée en examinant la déviation du point critique liant à partir des axes interatomiques entre les deux atomes. Une déviation large implique une tension plus élevée.
Quelques applications
La QTAIM est appliquée à la description de certains cristaux organiques présentant des distances ingénéralement courtes pour des molécules voisines comme observées par diffractométrie de rayons X. Ainsi, par exemple, dans la structure cristalline du chlore moléculaire, la distance Cl-Cl entre deux molécules est de 327 micromètres, plus faibles que la somme des rayons de Van der Waals (260 micromètres). Ainsi, la QTAIM prévoit douze chemins de liaison partant de chaque atome de chlore vers chaque autra atome de chlore, y compris l'autre atome de chlore dans la molécule. La théorie vise aussi à expliquer les propriétés métalliques de l'hydrogène métallique de manière quasi-identique.
La théorie est aussi appliquée à ce qu'on nomme les liaisons hydrogène-hydrogène[2] qui se produisent dans des molécules comme le phénanthrène ou le chrysène. Dans ces composés, la distance entre deux atomes d'hydrogène en position ortho est plus courte que leurs rayons de Van der Waals et selon des expériences numériques basées sur cette théorie, un chemin de liaison a été identifié entre eux. Les deux atomes d'hydrogène montrent des densités électroniques semblables et des couches proches, quoique particulièrement différentes de ce qu'on nomme des liaisons dihydrogène qui sont postulées pour des composés comme (CH3) 2NHBH3 et aussi différentes des interactions agostiques.
En chimie «classique», la proximité immédiate de deux atomes non liés conduit à une répulsion stérique déstabilisante, mais en QTAIM les interactions hydrogène-hydrogène observées sont en fait stabilisantes. Il est de fait bien connu que les isomères «noués» phénanthrène et chrysène sont plus stables d'environ 6 kcal/mol que leurs isomères linéaires respectifs l'anthracène et le tétracène. Une explication «classique» est donnée par la règle de Clar. La QTAIM montre qu'une stabilisation de 8 kcal/mole se produit pour le phénanthrène, résultant du transfert électronique du carbone à l'hydrogène, décalé de 12, 1 kcal/mol comparé à la stabilisation due au chemin de la liaison H-H. La densité électronique au point critique entre les deux atomes d'hydrogène est faible, de 0, 012 e- pour le phénanthrène. Une autre des propriétés du chemin de liaison est sa courbure.
Un autre exemple des molécules étudiées en QTAIM est le biphényle. Ses deux cycles phényle font un angle de 38° l'un comparé à l'autre comparé à la géométrie moléculaire plane (qui se rencontre lors de la rotation autour de la liaison C-C centrale) déstabilisée de 2, 1 kcal/mol et comparé à la géométrie perpendiculaire déstabilisée de 2, 5 kcal/mol. L'explication classique de cette barrière de rotation sont les répulsions stériques entre les atomes d'hydrogène en ortho (plans) et la perte de la délocalisation de la densité électronique π sur les deux cycles (perpendiculaires).
En QTAIM, l'augmentation de l'énergie lors de la diminution de l'angle diédral de 38° à 0° est une somme de plusieurs facteurs. Les facteurs de déstabilisation sont l'augmentation de la longueur de liaison entre les atomes de carbone liants (dans la mesure où ils doivent réagir à l'approche des atomes d'hydrogène) et le transfert de charge électronique entre carbone et hydrogène. Les facteurs de stabilisation sont la délocalisation croissante des électrons π d'un cycle à l'autre et la liaison hydrogène-hydrogène entre les atomes hydrogènes ortho.
La nature de la liaison hydrogène-hydrogène et ses propriétés restent sujettes à questionnement. Selon certains, la stabilité relative du phénanthrène comparée à celle de son isomère peut être expliquée en comparant les stabilisations de résonance[3]. Une autre critique[4] émise indique que la stabilité du phénanthrène peut être attribuée à un recouvrement π-π plus effectif sur la double liaison centrale, l'existence de chemins de liaisons n'étant pas contestée au contraire de l'énergie de stabilisation dérivée.
Références
- ↑ Atoms in Molecules : A Quantum Theory de Richard Bader
- ↑ Hydrogen - Hydrogen Bonding : A Stabilizing Interaction in Molecules and Crystals Cherif F. Matta, Jesus Hernandez-Trujillo, Ting-Hua Tang, Richard F. W. Bader Chem. Eur. J. 2003, 9, 1940 ± 1951 DOI :10.1002/chem. 200204626
- ↑ Molecular Recognition in Organic Crystals : Directed Intermolecular Bonds or Nonlocalized Bonding? Jack D. Dunitz and Angelo Gavezzotti Angew. Chem. Int. Ed. 2005, 44, 1766 – 1787 DOI :10.1002/anie. 200460157
- ↑ Polycyclic Benzenoids : Why Kinked is More Stable than Straight Jordi Poater, Ruud Visser, Miquel Sola, F. Matthias Bickelhaupt J. Org. Chem. 2007, 72, 1134-1142 DOI :jo061637p
Liens externes
- (en) Cet article est partiellement ou en totalité issu d'une traduction de l'article de Wikipédia en anglais intitulé «Atoms in Molecules».
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 12/04/2009.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.


 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité