Système conjugué
Un dispositif chimique est dit conjugué s'il forme un dispositif d'atomes liés de façon covalente avec au moins une liaison π délocalisée, au contraire de ce que la représentation de Lewis pourrait laisser penser, ce qui sert à représenter...
Recherche sur Google Images :

Source image : www.faidherbe.org Cette image est un résultat de recherche de Google Image. Elle est peut-être réduite par rapport à l'originale et/ou protégée par des droits d'auteur. |
Page(s) en rapport avec ce sujet :
- liaisons. 6 électrons délocalisés sur toute la molécule. Double liaison : hybridation sp... Dispositif non conjugué. La conjugaison repose sur la superposition des orbitales..... encapsulation système flexible (effet barrière)... (source : catalogue.polytechnique)
- double liaison conjuguée double liaison exocyclique... La structure originale de ce dispositif conjugué peut être décrite par la méthode de la mésomérie ou... (source : faidherbe)
- Plan • Généralités sur les matériaux organiques • Les dispositifs conjugués • Le... Conjugaison = alternance de simples et doubles liaisons Double liaison :..... BAG – encapsulation du système indispensable • Encapsulation du système... (source : scribd)
Un dispositif chimique est dit conjugué s'il forme un dispositif d'atomes liés de façon covalente avec au moins une liaison π délocalisée, au contraire de ce que la représentation de Lewis pourrait laisser penser, ce qui sert à représenter ce dispositif sous plusieurs représentations de Lewis, dites mésomères, résonantes ou canoniques.
Type de conjugaison
La conjugaison, origine de cette délocalisation, peut être de différentes natures :
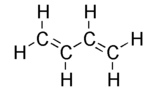
- Conjugaison de type π-σ-π : c'est une «alternance» de liaisons simples et multiples (c'est-à-dire double ou triple, comme par exemple C=C-C=C-C) dans une molécule ou un matériau. L'exemple le plus simple de la conjugaison π-σ-π est le buta-1, 3-diène, représenté ci-dessous.
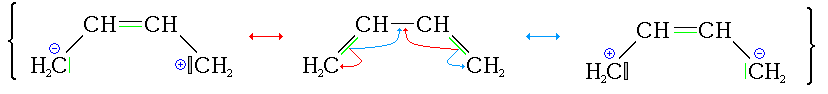
Ce composé présente - formellement - deux liaisons doubles sur les trois liaisons présentes entre les atomes de carbone. De fait, les liaisons se délocalisent sur la totalité du squelette carboné en apportant un caractère de liaison double sur la liaison centrale (formellement simple) et font apparaitre des charges en bouts de chaîne.
- Conjugaison de type π-σ-n : il s'agit de la suite liaison double/liaison simple/atome porteur d'un doublet libre (chargé ou non). C'est surtout le cas des anions d'allyle, ou des alcènes halogénés.
- Conjugaison de type π-σ-v : il s'agit de la suite liaison double/liaison simple/atome portant une lacune électronique (chargé ou non). C'est le cas par exemple des cations d'allyle
- Conjugaison de type π-σ-e : il s'agit de la suite liaison double/liaison simple/atome portant un électron non apparié. C'est le cas des radicaux d'allyle.
- Conjugaison de type n-σ-v : il s'agit de la totalité atome portant une lacune électronique, liaison simple, atome porteur un doublet libre.
Ces dispositifs amènent à une délocalisation générale des électrons sur l'ensemble des orbitales p alignées, parallèles et adjacentes des atomes, ce qui abaisse leur énergie et augmente ainsi leur stabilité.
Conséquences de la délocalisation
La délocalisation des électrons crée une région où ils n'appartiennent pas à une seule liaison ou atome, mais plutôt à un groupe, les différences de probabilités de présence dans deux régions de l'espace voisines (ici pour une chaîne d'atomes) s'amoindrissent (on donne l'image d'un déplacement continu des électrons entre deux liaisons consécutives). Ces modifications correspondent à une combinaison de formes mésomères (dites aussi résonantes ou canoniques) telle que l'énergie du dispositif soit minimale (donc il s'agit du minimum absolu de la surface d'énergie potentielle associée aux présences électroniques) : cette notion est quelquefois présentée par l'introduction d'un pourcentage de localisation de la liaison.
Cette stabilisation du dispositif par délocalisation des électrons a des effets sur sa réactivité : elle facilitera par exemple la formation d'un produit plutôt que celle de son isomère, le premeier étant stabilisé par mésomérie, ou facilitera la stabilité d'un intermédiaire réactionnel plutôt qu'un autre, orientant la réaction selon un mécanisme plutôt qu'un autre (compétition SN1/SN2 par exemple).
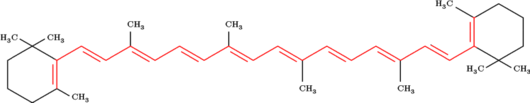
Les dispositifs conjugués possèdent des propriétés uniques qui donnent des couleurs intenses. De nombreux pigments utilisent des dispositifs d'électrons conjugués, comme la longue chaîne d'hydrocarbure conjuguée du ß-carotène, donnant une couleur fortement orangée. Lorsque un électron du dispositif absorbe un photon de lumière de la bonne longueur d'onde, il peut être porté à un niveau d'énergie plus élevé (voir particule dans une boîte). La majorité de ces transitions électroniques se font d'un électron d'une orbitale pi vers une orbitale pi antiliante (π vers π*), un électron non liant peut aussi être déplacé (n vers π*). Les dispositifs conjugués de moins de huit doubles liaisons conjuguées absorbent seulement dans les ultraviolets et apparaissent incolores à l'œil humain. À chaque double liaison ajoutée, le dispositif absorbe des photons qui plus est grande longueur d'onde (et par conséquent qui plus est basse énergie), et la couleur du composé couvre du bleu au jaune. Les composés orange ou rouges ne s'appuient typiquement pas que sur les seules doubles liaisons.
L'absorption de la lumière du spectre ultraviolet à visible peut être mesurée avec la spectroscopie UV/Visible. L'absorption de la lumière forme la base de toute la photochimie.
Les dispositifs conjugués forment la base des chromophores, qui sont les parties absorbant la lumière d'une molécule, qui peuvent rendre un composé coloré. De tels chromophores sont fréquemment présents dans des composés organiques variés, et quelquefois présents dans les polymères, qui sont colorés ou brillent dans le noir. Ils sont généralement causés par les dispositifs annulaires conjugués avec des liaisons comme C=O et N=N en plus des liaisons C-C conjuguées.
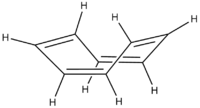
La conjugaison dans les structures cycliques a pour résultat l'aromaticité, une stabilité inhabituelle présente dans certains dispositifs conjugués cycliques.
Simplement posséder des liaisons simples et doubles en alternance n'est pas obligatoirement suffisant à un dispositif pour être conjugué. Certains hydrocarbures cycliques (comme le cyclooctatétraène) possèdent en effet une alternance liaison simple/double. Quoique la molécule puisse apparaitre plane en ne regardant que sa structure chimique, la molécule ne l'est pas, et adopte typiquement une conformation "bateau". Puisque les orbitales p de la molécule ne peuvent pas s'aligner, les électrons ne sont pas partagés entre les atomes de carbone, et le dispositif n'est pas conjugué.
Exemples communs
Voir aussi
- Mésomérie
- Hyperconjugaison
- Conjugaison croisée
- Aromaticité
- liaison chimique
Source
- (en) Cet article est partiellement ou en totalité issu d'une traduction de l'article de Wikipédia en anglais intitulé «Conjugated system».
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 13/04/2009.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.


 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité