Liaison hydrogène
La liaison hydrogène ou pont hydrogène est une liaison physique non covalente, de type dipôle-dipôle. Elle est de basse intensité, et relie des molécules en impliquant un atome d'hydrogène.

Catégories :
Liaison chimique - Chimie quantique - Physique quantique - Réaction chimique - Hydrogène - Atome - Physique atomique
Recherche sur Google Images :

Source image : iramis.cea.fr Cette image est un résultat de recherche de Google Image. Elle est peut-être réduite par rapport à l'originale et/ou protégée par des droits d'auteur. |
Définitions :
- C'est une liaison de faible énergie qui se forme dans le cas de l'ADN entre les bases azotées complémentaires (A/T et C/G). (source : www-ed-sdvs.u-strasbg)
- Hydrogen bond Force d'origine électrostatique intermédiaire entre la liaison ionique et la force de van der Waals résultant du partage d&... (source : inra)
La liaison hydrogène ou pont hydrogène est une liaison physique non covalente, de type dipôle-dipôle. Elle est de basse intensité (vingt fois plus faible que liaison covalente classique), et relie des molécules en impliquant un atome d'hydrogène. On pensait à l'origine que le proton de cet atome était partagé entre les molécules liées[1], et par conséquent que cette liaison hydrogène était quasi-covalente. On sait actuellement qu'elle est à 90% électrostatique[2]. Quoique de la même famille que les forces de van der Waals, les liaisons hydrogène s'en distinguent par leur intensité : leur énergie de liaison est à peu près dix fois supérieure à celle de la force de van der Waals).
Pour que cette liaison s'établisse, il faut être en présence d'un donneur de liaison hydrogène et d'un accepteur :
- le donneur se compose d'un composé à pH acide, c'est-à-dire un hétéroatome (azote, oxygène, fluor) porteur d'un atome hydrogène (comme dans les amines, alcools, thiols) ;
- l'accepteur se compose d'un hétéroatome (seulement azote, oxygène ou fluor) porteur de doublets libres.
Quand une liaison hydrogène s'établit, les deux hétéroatomes se trouvent à une distance d'environ 2 Å, c'est-à-dire 0, 2nm.
Exemples : H2O ... H−O−H ; −C=O ... H−O−H
Conséquences de la liaison hydrogène
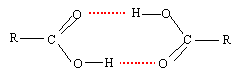
- La liaison hydrogène s'établit alors entre l'ensemble des molécules présentant les caractéristiques auparavant évoquées ; voyons par exemple le cas d'un acide carboxylique (R-COOH).
On remarque que l'ensemble des molécules sont liées entre elles au niveau de la fonction alcool. Le radical alkyl "R" aura alors une influence non-négligeable sur la force de cette liaison. En effet, la longueur de la chaine et sa composition vont polariser de façon plus ou moins marquée la liaison entre l'hydrogène et le carbone. Si la liaison H (comme on l'appelle plus fréquemment) est affaiblie, la cohésion inter-moléculaire le sera aussi et la température d'ébullition de la substance en question sera plus faible. C'est à dire, il faudra moins d'énergie (par le biais de la chaleur) pour séparer les molécules les unes des autres. Au contraire, pour l'eau (H2O), l'ammoniaque (NH3), ou le fluorure d'hydrogène (HF), la liaison X-H est tellement polarisée que les liaisons H qui s'établissent confèrent aux substances des points d'ébullition anormalement hauts.
- Une autre illustration peut être celle de l'eau solide (glace). En effet, la molécule d'eau est l'exemple typique de la liaison H. Les liaisons H s'établissent, de sorte que l'état liquide de l'eau est l'état le plus compact, alors que pour tout autre corps pur c'est l'état solide. Dans la glace, l'eau est en structure tétraèdrique (structure rendue envisageable par ces liaisons), et la compression d'un bloc de glace conduit au retour à l'état liquide. C'est pourquoi la glace occupe plus de volume que l'eau, en quantités identiques (le glaçon flotte sur l'eau).
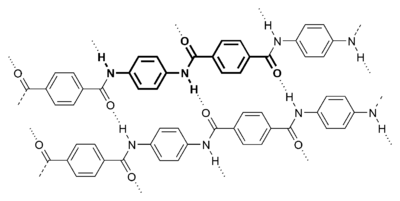
- Enfin - et quoique la liste ne puisse être exhaustive tant le domaine d'application de cette liaison est vaste - on mentionnera le cas des polymères, tel le Poly-para-phénylène téréphtalamide (plus connu sous le nom de Kevlar). Les chaines de polymères s'attachent entre elles par des liaisons H lui conférant ainsi ses propriétés si intéressantes de résistance. Pour en savoir plus : Kevlar.
Les liaisons hydrogène par type
Nous distinguons généralement trois types de liaisons hydrogène :
- faibles avec des enthalpies de liaison entre 10 - 50 kJ·mol−1 ;
- fortes avec des enthalpies entre 50 - 100 kJ·mol−1 ;
- très fortes avec des enthalpies > 100 kJ·mol−1.
Un exemple de liaison particulièrement forte est FH–F−1 dans KHF2 avec à peu près 212 kJ·mol−1. On peut penser que dans ce cas il vaut mieux écrire F–H–F. La distance totale entre F–H–F est de 2, 49 Å uniquement et il se forme un angle de 120° entre les différentes molécules.
Notes
Article connexe
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 13/04/2009.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.

 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité