Forces de London
Les forces de dispersion de London sont des forces faibles intermoléculaires créées par des dipôles induits. Elles représentent généralement la composante principale des forces de Van der Waals.
Les forces de dispersion de London sont des forces faibles intermoléculaires créées par des dipôles induits. Elles représentent généralement la composante principale des forces de Van der Waals. Elles tirent leur nom du physicien germano-américain Fritz London qui formula mathématiquement ces forces pour deux molécules semblables en 1937.
Les forces de London existent du fait que la densité électronique des molécules est probabiliste : il y a une forte chance à tout moment pour que celle-ci ne soit pas équitablement répartie à travers la molécule, ce qui crée un léger moment dipolaire. Les moments dipolaires vont fluctuer particulièrement rapidement au cours du temps. Ainsi à chaque distribution inhomogène se crée un moment dipolaire induit qui peut interagir avec les moments dipolaires induits des molécules voisines et une force s'exerce entre les molécules. Naturellement, ces dipôles induits peuvent aussi réagir avec un dipôle permanent (molécule polaire) mais les forces qui en résultent prennent alors le nom de forces de Debye. L'effet apparaît aussi dans les molécules polaires, mais c'est alors les forces de Keesom qui prennent le dessus le plus fréquemment et les forces de London jouent alors un rôle fréquemment minime dans les interactions entre dipôles permanents.
Généralement, pour des molécules polaires, les forces de London sont particulièrement faibles devant les autres forces intermoléculaires, par exemple les interactions ioniques ou les liaisons hydrogène ou les forces de Keesom entre dipôles permanents. Néanmoins, pour des molécules neutres (comme l'hélium), les forces de London sont l'unique force attractive intermoléculaire à longue distance. Elles sont aussi prépondérantes dans les forces d'attraction entre molécules non polaires comme le diazote ou le méthane ou même les gaz rares. Sans l'effet des forces de London, il serait impossible de liquéfier ces gaz.
Formulation
L'énergie des forces de dispersion de London Elondon entre deux molécules de polarisabilité différentes peuvent se poser sous la forme :
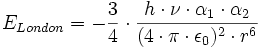
avec :
- h constante de Plank (6, 626.10-34 J. s)
- ν la fréquence électronique d'absorption (Hz)
- α la polarisabilité électrique (C². m². J-1)
- ε0 la permittivité diélectrique du vide (8, 854.10-12 C². J-1. m-1)
- r la distance moyenne entre les molécules (m)
L'expression des forces s'obtient en dérivant l'énergie comparé à la distance moyenne entre les molécules. En simplifiant, la force s'écrit sous la forme :
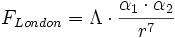 avec Λ constante.
avec Λ constante.
Les forces de London croissent avec la taille des molécules mises en jeu, car l'augmentation de la taille va avec la dispersion du nuage électronique et par conséquent une augmentation du moment dipolaire induit. Cet effet peut se constater sur les dihalogènes (F2, Cl2, Br2, I2) : alors que le difluor et le dichlore sont à l'état de gaz dans les conditions de pression et de température normale, le dibrome est liquide et le diiode solide.
Voir aussi
Recherche sur Google Images : |
|
"... forces de London relativement ..." L'image ci-contre est extraite du site users.skynet.be Il est possible que cette image soit réduite par rapport à l'originale. Elle est peut-être protégée par des droits d'auteur. Voir l'image en taille réelle (200 x 347 - 16 ko - jpg)Refaire la recherche sur Google Images |
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 13/04/2009.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.


 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité