Spectre de l'atome d'hydrogène
Le spectre de l'hydrogène est la totalité des longueurs d'onde présentes dans la lumière que l'atome d'hydrogène est capable d'émettre.
Recherche sur Google Images :

Source image : fr.wikipedia.org Cette image est un résultat de recherche de Google Image. Elle est peut-être réduite par rapport à l'originale et/ou protégée par des droits d'auteur. |
Page(s) en rapport avec ce sujet :
- Diagramme d'énergie de l'atome d'hydrogène : Reportons ces différentes énergies dans le ... ou de longueur d'onde l (dans le spectre de la lumière éclairant l'atome, ... On voit que le spectre d'émission (ou d'absorption) de l'hydrogène... (source : e.m.c.2.free)
- ... L'atome d'hydrogène est l'atome le plus simple et c'est lui qui possède le ... Puisque les longueurs d'onde des photons émis et des photons absorbés.... L'étude des raies d'absorption dans le spectre d'une étoile permet... (source : acces.inrp)
- En mesurant la longueur d'onde des ondes électromagnétiques... les mêmes valeurs que celles obtenues lors des mesures du spectre de l'atome d'hydrogène.... (source : books.google)
Le spectre de l'hydrogène est la totalité des longueurs d'onde présentes dans la lumière que l'atome d'hydrogène est capable d'émettre.
Ce spectre lumineux se compose de longueurs d'onde discrètes dont les valeurs sont données par la formule de Rydberg :
où
- λ est la longueur d'onde de la lumière dans le vide.
- RH est la constante de Rydberg de l'hydrogène.
- n1 et n2 sont des entiers tels que n1 < n2.
Interprétation
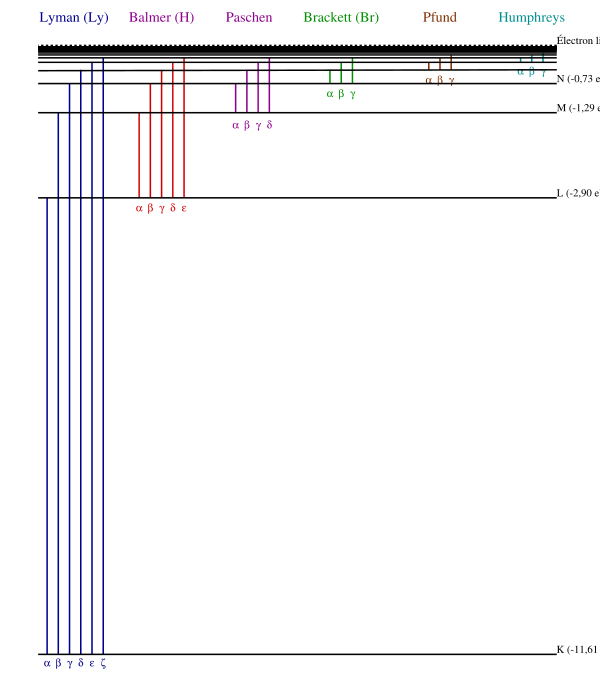
L'hydrogène est le premier atome de la classification périodique. Il est constitué d'un proton et d'un électron. L'énergie de l'électron dans le référentiel barycentrique ne peut prendre que quelques valeurs discrètes, nommées niveaux d'énergie (voir modèle de Bohr). Quand l'électron passe d'un niveau élevé à un niveau plus bas, il émet un photon dont l'énergie vaut la différence entre celles des deux niveaux. Ainsi, la lumière émise ne peut prendre que quelques valeurs discrètes. C'est ce qu'on nomme son spectre.
Vérifications expérimentales
- Spectre du Soleil.
- Lampe à hydrogène
- Spectre de l'eau et de l'eau lourde
Voir aussi
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 13/04/2009.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.

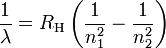

 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité