Vibration moléculaire
Une vibration moléculaire se produit quand les atomes d'une molécule sont dans un mouvement périodique pendant que la molécule dans son ensemble subit un mouvement de translation et rotation.
Recherche sur Google Images :

Source image : www.uqac.ca Cette image est un résultat de recherche de Google Image. Elle est peut-être réduite par rapport à l'originale et/ou protégée par des droits d'auteur. |
Page(s) en rapport avec ce sujet :
- Toutes les liaisons chimiques possèdent des fréquences de vibration qui... 1A) car la vibration moléculaire est particulièrement forcée par différence de ... (source : id.erudit)
Une vibration moléculaire se produit quand les atomes d'une molécule sont dans un mouvement périodique pendant que la molécule dans son ensemble subit un mouvement de translation et rotation. La fréquence du mouvement périodique est nommée fréquence de vibration. Une molécule non-linéaire constitué de n atomes possède 3n−6 modes normaux de vibration, tandis qu'une molécule linéaire n'en possède que 3n−5 modes normaux de vibration, puisque la rotation autour de son axe moléculaire ne peut être observée. Une molécule diatomique ne possède ainsi qu'un mode normal de vibration. Les modes normaux des molécules polyatomiques sont indépendants les uns des autres, chacun d'entre eux impliquant des vibrations simultanées des différentes parties de la molécule.
Une vibration moléculaire est produite quand la molécule absorbe un quantum d'énergie, E, correspond à une vibration de fréquence, ν, selon la relation bien connue E=hν, où h est la constante de Planck. Une vibration principale est excitée quand un tel quantum d'énergie est absorbé par la molécule dans son état essentiel. Quand deux quanta sont absorbés la première harmonique est excitée, et ainsi de suite pour les harmoniques suivantes.
En première approximation, le mouvement de vibration normal peut être décrit comme une sorte de mouvement harmonique simple. Dans cette approximation, l'énergie de vibration est une fonction quadratique (parabole) des déplacements atomiques et la première harmonique est de deux fois la fréquence de la fréquence principale. En réalité, les vibrations sont anharmoniques et la première harmonique a une fréquence qui est un peu inférieure à deux fois la principale. L'excitation des harmoniques supérieures demande progressivement de moins en moins d'énergie supplémentaire et conduit à la dissociation de la molécule, l'énergie potentielle de la molécule ressemblant plus à un potentiel de Morse.
Les états vibrationnels d'une molécule peuvent être étudiés selon plusieurs voies. La plus directe est la spectroscopie infrarouge, les transitions vibrationnelles requérant une quantité d'énergie qui correspond typiquement à la région infrarouge du spectre. La spectroscopie Raman, qui utilise typiquement la lumière visible, peut aussi être utilisée pour mesurer les fréquences de vibration directement.
L'excitation de vibration peut se produire de manière conjuguée à l'excitation électronique (transition vibronique), donnant une structure vibrationnelle fine aux transitions électroniques, en particulier avec les molécules à l'état gazeux.
L'excitation simultané d'une vibration et des rotations donne naissance au spectre de rotation-vibration.
Coordonnées vibrationnelles
La coordonnée d'une vibration normale est une combinaison de «changements» dans les positions des atomes d'une molécule. Quand la vibration est excitée, la coordonnée change de manière sinusoïdale avec une fréquence ν, la fréquence de vibration.
Coordonnées internes
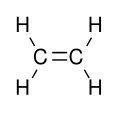
Les coordonnées internes sont des types suivants, comme illustré à partir de la molécule plane d'éthène, et fréquemment désignés par les termes anglophones :
- Stretching (étirement) : variation de la longueur d'une liaision, comme C-H ou C-C.
- Bending (pliage) : variation dans l'angle fait par deux liaisons, comme par exemple l'angle HCH dans un groupe méthylène.
- Rocking (balancement) : variation dans l'angle entre un groupe d'atomes, comme par exemple un groupe méthylène et le reste de la molécule.
- Wagging (agitation) : variation de l'angle entre le plan d'un groupe d'atomes, comme un groupe méthylène et un plan passant par le reste de la molécule.
- Twisting (torsion) : variation dans l'angle fait par les plans respectifs de deux groupes d'atomes, comme par exemple entre les deux groupes méthylènes.
- Hors du plan : mouvement non présent dans l'éthène, mais qui peut se rencontrer par exemple dans BF3 quand l'atome de bore sort et revient dans le plan constitué par les trois atomes de fluor.
Dans les coordonnés de rocking, wagging ou twisting, les angles et longueurs de liaisons dans les groupes concernés ne changent pas. Le rocking peut être distingué du wagging par le fait que les atomes dans le groupe restent dans le même plan.
Dans l'éthène, il y a douze coordonnées internes : 4 stretchings C-H, 1 streching C-C, 2 bendings H-C-H, 2 rockings CH2, 2 wagging CH2, 1 twisting. Les angles H-C-C ne peuvent être utilisés comme coordonnées internes, les angles à chaque carbone ne pouvant fluctuer en même temps.
Coordonnées adaptées à la symétrie
Des coordonnées adaptées à la symétrie peuvent être créées en appliquant un projecteur à un ensemble de coordonnées internes[1]. Le projecteur est construit avec l'aide de la table de caractères du groupe ponctuel de symétrie moléculaire. Ainsi, les quatre coordonnées de stretching C-H (non-normalisées) de la molécule d'éthène sont données par :
- Qs1 = q1 + q2 + q3 + q4
- Qs2 = q1 + q2 - q3 - q4
- Qs3 = q1 - q2 + q3 - q4
- Qs4 = q1 - q2 - q3 + q4
où q1 - q4 sont les coordonnées internes pour les stretching de chacune des quatre liaisons C-H.
Des illustrations de coordonnées adaptées à la symétrie pour la majorité des petites molécules peuvent être trouvées dans l'ouvrage de Nakamoto[2].
Conditions normales
Une coordonnée normale, Q, peut quelquefois être construite directement comme une coordonnée adaptée à la symétrie. C'est envisageable quand la coordonnée normale appartient seulement à une représentation irréductible spécifique d'un groupe ponctuel de symétrie moléculaire. Ainsi, les coordonnées adaptées à la symétrie pour l'étirement de liaison de la molécule linéaire de dioxyde de carbone, O=C=O, sont toutes deux des coordonnées normales :
- étirement symétrique : la somme des deux coordonnées de stretching de C-O, les deux longueurs de liaisons C-O sont modifiées semblablement et l'atome de carbone est stationnaire. Q = q1 + q2.
- étirement asymétrique : la différence des deux coordonnées de stretching de C-O ; une liaison C-O croît quand l'autre décroît. Q = q1 - q2.
Quand deux coordonnées normales ou plus appartiennent à la même représentation irréductible d'un groupe de symétrie ponctuelle moléculaire (c'est-à-dire ont la même symétrie), il y a «mélange» et les cœfficients de la combinaison ne peuvent être déterminé a priori. Ainsi par exemple, dans la molécule linéaire de cyanure d'hydrogène, HCN, les deux vibrations de stretching sont :
- streching C-H majoritaire avec stretching C-N faible ; Q1 = q1 + a q2 (a << 1).
- streching C-N majoritaire avec stretching C-H faible ; Q1 = b q1 + q2 (b << 1).
Les cœfficient a et b sont déterminés par analyse complète des coordonnées normales au moyen de la méthode GF de Wilson[3].
En mécanique classique (newtonienne)
De manière peut-être étonnante, les vibrations moléculaires peuvent être traitées en utilisant la mécanique classique pour calculer les fréquences de vibrations correctes. Le postulat de base est que chaque vibration peut être traitée comme si elle correspondait à un ressort. Dans l'approximation harmonique, un ressort obéit à la loi de Hooke : la force requise pour étirer le ressort est proportionnelle à son extension. Le cœfficient de proportionnalité est connue sous le nom de constante de force f. L'oscillateur anharmonique sera considéŕe d'autre part[4].
Selon la deuxième loi du mouvement de Newton, cette force est identique au produit de la masse m par l'accélération a :
Par identité, on obtient l'équation suivante :
La solution à cette équation du mouvement harmonique simple est :
A est le maximum d'amplitude de la coordonnée de vibration Q. Il reste à définir la masse, m. Dans une molécule homonucléaire diatomique comme N2, il s'agit simplement de la masse des deux atomes. Dans le cas d'une molécule diatomique hétéronucléaire, AB, elle correspond à la masse réduite, μ définie par :
L'utilisation de la masse réduite permet d'assurer que le centre de masse de la molécule ne soit pas affecté par la vibration. Dans l'approximation harmonique, l'énergie potentielle de la molécule est une fonction quadratique de la coordonnée normale. Il s'ensuit que la constante de force est identique à la dérivée seconde de cette énergie potentielle.
Quand deux vibrations normales ou plus ont la même symétrie, une analyse des coordonnées normales complète doit être effectuée (voir méthode GF). Les fréquences de vibrations, νi, sont obtenues à partir des valeurs propres, λi, du produit matriciel GF. G est la matrice de nombres dérivés des masses des atomes et de la géométrie de la molécule[3] et F est une matrice dérivée des constantes de forces. Qui plus est amples informations sur la détermination de ces valeurs propres peuvent être obtenues en consultant l'ouvrage de P. Gans[5].
En mécanique quantique
Dans l'approximation harmonique, l'énergie potentielle est une fonction quadratique des conditions normales. En résolvant l'équation de Schrödinger, les états énergétiques pour chaque coordonnée normale sont données par :
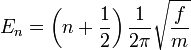 ,
,
où n est un nombre quantique pouvant prendre comme valeurs 0, 1, 2... La différence dans l'énergie quand n fluctue de 1 est ainsi identique à l'énergie dérivée utilisée en mécanique classique. On pourra se reporter à l'article oscillateur harmonique quantique pour plus de précisions. Connaissant les fonctions d'ondes, certaines règles de sélection peuvent être formulées. Ainsi, pour un oscillateur harmonique, les transitions sont permises uniquement lorsque le nombre quantique est modifié d'une unité,
mais cela ne s'applique pas à un oscillateur anharmonique ; l'observation des harmoniques est uniquement envisageable car les vibrations sont anharmoniques. Une autre conséquence de l'anharmonicité est que les transitions comme entre les états n=2 et n=1 ont un tout petit peu moins d'énergie que les transitions entre l'état essentiel et le premier état excité. Une telle transition donne une croissance vers une bande chaude.
Intensités
Dans un spectre infrarouge, l'intensité d'une bande d'absorption est proportionnelle à la dérivée au moment dipôlaire moléculaire comparé à la coordonnée normale[6]. L'intensité des bandes Raman dépend de la polarisabilité. Voir aussi moment de transition dipolaire.
Références
- ↑ F. A. Cotton Chemical applications of group theory, Wiley, 1962, 1971
- ↑ K. Nakamoto Infrared and Raman spectra of inorganic and coordination compounds, 5th. edition, Part A, Wiley, 1997
- ↑ a b E. B. Wilson, J. C. Decius and P. C. Cross, Molecular vibrations, McGraw-Hill, 1955. (Reprinted by Dover 1980)
- ↑ S. Califano, Vibrational states, Wiley, 1976
- ↑ P. Gans, Vibrating molecules, Chapman and Hall, 1971
- ↑ D. Steele, Theory of vibrational spectroscopy, W. B. Saunders, 1971
Voir aussi
|
|
Pour approfondir
- P. M. A. Sherwood, Vibrational spectroscopy of solids, Cambridge University Press, 1972
Liens externes
- (en) Code Free Molecular Vibration développé par Z. Szabo et R. Scipioni
- (en) Absorption et vibration moléculaire
- (en) Explication simple du spectre de vibration et table incluant les constantes de force
- (en) Tables de caractères pour les groupes ponctuels chimiquement importants
- (en) Cet article est partiellement ou en totalité issu d'une traduction de l'article de Wikipédia en anglais intitulé «Molecular vibration».
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 13/04/2009.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.

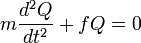
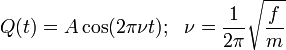
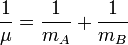
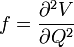
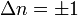

 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité