Spectrophotométrie
La spectrophotométrie est une méthode analytique quantitative qui consiste à mesurer l'absorbance ou la densité optique d'une substance chimique donnée en solution.
Recherche sur Google Images :
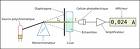
Source image : fr.wikipedia.org Cette image est un résultat de recherche de Google Image. Elle est peut-être réduite par rapport à l'originale et/ou protégée par des droits d'auteur. |
Page(s) en rapport avec ce sujet :
- Ainsi, à la longueur d'onde de 10µm du domaine infrarouge correspondent... l est l'épaisseur de la cuve et c la concentration de la solution. Loi de Beer - Lambert. Finalement la relation principale utilisée en spectrophotométrie est ... (source : dalmeyda.chez)
- La spectrophotométrie est une technique assez récente qui doit son essor aux.... solution acide (jaune) n'absorbe rien dans cette longueur d'onde, ... (source : etudiants)
- ... La longueur d'onde l est la distance (m) parcourue par le front d'onde durant... Cette loi est vérifiée quand la solution est de concentration inférieure... La relation principale utilisée en spectrophotométrie est ... (source : chimix)
La spectrophotométrie est une méthode analytique quantitative qui consiste à mesurer l'absorbance ou la densité optique d'une substance chimique donnée en solution. Plus cette espèce est concentrée plus elle absorbe la lumière dans les limites de proportionnalités énoncées par la loi de Beer-Lambert.
La densité optique des solutions est déterminée par un spectrophotomètre préalablement étalonné sur la longueur d'onde d'absorption de l'espèce chimique à étudier.
Principe
Pour plus de détails, voir l'article Loi de Beer-Lambert
Quand une lumière d'intensité 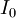 passe à travers une solution, une partie de celle ci est absorbée par le (s) soluté (s). L'intensité
passe à travers une solution, une partie de celle ci est absorbée par le (s) soluté (s). L'intensité 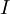 de la lumière transmise est par conséquent inférieure à
de la lumière transmise est par conséquent inférieure à 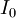 . On définit l'absorbance de la solution comme :
. On définit l'absorbance de la solution comme :
On parle aussi de transmittance définie par la relation :
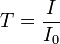 c'est-à-dire que
c'est-à-dire que 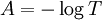
L'absorbance est une valeur positive, sans unité. Elle est d'autant plus grande que l'intensité transmise est faible.
La relation de Beer-Lambert décrit que, à une longueur d'onde λ donnée, l'absorbance d'une solution est proportionnelle à la concentration des espèces de la solution, ainsi qu'à la longueur du trajet optique (distance sur laquelle la lumière traverse la solution).
Alors, pour une solution limpide contenant une seule espèce absorbante :
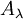 est l'absorbance ou la densité optique de la solution pour une longueur d'onde λ ;
est l'absorbance ou la densité optique de la solution pour une longueur d'onde λ ; (en mol. L-1) est la concentration de l'espèce absorbante ;
(en mol. L-1) est la concentration de l'espèce absorbante ;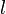 (en cm) est la longueur du trajet optique ;
(en cm) est la longueur du trajet optique ;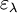 (en mol-1. L. cm-1) est le cœfficient d'extinction molaire de l'espèce absorbante en solution. Il rend compte de la capacité de cette espèce à absorber la lumière, à la longueur d'onde λ.
(en mol-1. L. cm-1) est le cœfficient d'extinction molaire de l'espèce absorbante en solution. Il rend compte de la capacité de cette espèce à absorber la lumière, à la longueur d'onde λ.
La loi de Beer-Lambert est additive (mais non la transmittance). Ainsi, pour une solution contenant plusieurs espèces absorbantes, l'absorbance de la solution est la somme de leurs absorbances. Pour n espèces absorbantes :
Domaine UV-visible de la spectrophotométrie
Pour plus de détails, voir l'article Spectroscopie
Un soluté coloré ou chromophore absorbe la lumière visible (longueurs d'onde comprises entre 400 et 800 nm). On parle de spectrophotocolorimétrie ou plus simplement de colorimétrie. Certaines solutions absorbent dans l'ultraviolet (longueurs d'onde inférieures à 380 nm), on parle alors de spectrophotométrie UV. Les infrarouges ne sont pas utilisés en spectrophotométrie car ils dépendent en particulier de la température de la solution et non de sa concentration, ils sont plutôt couverts par la spectroscopie en infrarouge. La spectrophotométrie est plus spécifique que la spectroscopie qui couvre d'autres longueurs d'ondes du spectre électromagnétique.
Spectrophotomètre
Pour plus de détails, voir l'article Spectrophotomètre
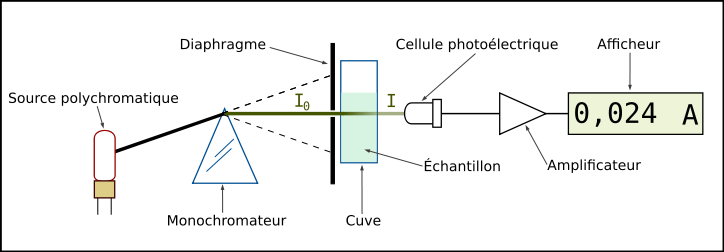
Un spectrophotomètre mesure l'absorbance d'une solution à une longueur d'onde donnée. Un système monochromateur sert à générer, à partir d'une source de lumière visible ou ultraviolette, une lumière monochromatique, dont la longueur d'onde est choisie par l'utilisateur. La lumière monochromatique incidente d'intensité 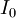 traverse alors une cuve contenant la solution étudiée, et l'appareil mesure l'intensité
traverse alors une cuve contenant la solution étudiée, et l'appareil mesure l'intensité 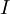 de la lumière transmise. La valeur affichée par le spectrophotomètre est l'absorbance à la longueur d'onde étudiée. Le spectrophotomètre est parfois utilisé pour mesurer de manière instantanée une absorbance à une longueur d'onde donnée, ou pour produire un spectre d'absorbance (spectrophotomètre à balayage). Dans ce dernier cas, le système monochromateur décrit en un temps court la totalité des longueurs d'onde comprises entre deux valeurs choisies par l'opérateur.
de la lumière transmise. La valeur affichée par le spectrophotomètre est l'absorbance à la longueur d'onde étudiée. Le spectrophotomètre est parfois utilisé pour mesurer de manière instantanée une absorbance à une longueur d'onde donnée, ou pour produire un spectre d'absorbance (spectrophotomètre à balayage). Dans ce dernier cas, le système monochromateur décrit en un temps court la totalité des longueurs d'onde comprises entre deux valeurs choisies par l'opérateur.
Limites
Plusieurs facteurs peuvent dégrader la loi de Beer-Lambert et limiter la validité de la spectrophotométrie :
- Le domaine de mesure parfait est pour les valeurs de T localisées entre 20 et 60%.
- Plusieurs aberrations optiques liés à la diffusion, la réflexion et la diffraction de la lumière peuvent fausser la mesure.
- Les phénomènes de fluorescence mais aussi d'autres particularités chimiques liées aux espèces absorbantes peuvent interférer.
- Plus la densité du soluté est importante, plus le faisceau de lumière incident sera réfracté avec une valeur donnée. Cette tendance est normalement infime mais devient plus prononcée avec les hautes concentrations. Ainsi, la réfraction diminué l'intensité de la lumière transmise et l'instrument indique faussement une absorbance plus élevée. Le plus souvent, ce phénomène peut être évité en œuvrant avec des concentrations inférieures à 0, 01 mol. l-1.
Importance du phénomène de diffusion [1]
Comme la loi de Beer-Lambert le stipule, le pouvoir d'un milieu à bloquer le passage de la lumière est quantifié par un cœfficient d'extinction donné par l'équation :
Cette impédance est générée par deux phénomènes différents : l'absorbance et la diffusion.
- La diffusion intervient quand la lumière est défléchie par les particules du milieu de façon à ne pas atteindre l'autre côté de l'échantillon.
- L'absorbance est le processus par lequel l'énergie lumineuse est absorbée par les molécules de l'échantillon avant d'être libérée sous forme de chaleur ou emmagasinée sous forme de liaisons chimiques.
Donc que le cœfficient 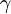 de l'équation précédente est composé par le cœfficient de diffusion (
de l'équation précédente est composé par le cœfficient de diffusion (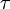 ) mais aussi celui de l'absorption (
) mais aussi celui de l'absorption (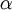 ), autrement dit :
), autrement dit :
Le cœfficient de diffusion peut être exprimé par le produit de la concentration des particules, 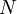 , et la section efficace de celles-ci,
, et la section efficace de celles-ci, 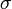 (à supposer que ces particules sont homogènes et régulièrement réparties dans le milieu), on a :
(à supposer que ces particules sont homogènes et régulièrement réparties dans le milieu), on a :
La section efficace, qui est une mesure de la proportion de lumière diffusé par particule, dépend de leur taille. En effet, pour les particules de petite taille (p. ex. leur diamètre représente 10% de la longueur d'onde incidente) la diffusion de Rayleigh prédomine. La diffusion de Rayleigh dépend de la longueur du parcours, de la concentration des particules diffusantes, de la longueur d'onde et de la polarisation de cette dernière. Pour une particule parfaitement sphérique, la section efficace de Rayleigh s'écrit :
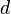 est le diamètre des particules,
est le diamètre des particules, 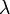 est la longueur d'onde,
est la longueur d'onde, 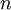 est l'indice de réfraction.
est l'indice de réfraction.
Cette équation prédit que les courtes longueur d'ondes seront les plus diffusées.
Pour des particules plus grosses que la longueur d'onde, elles font l'objet d'un phénomène plus complexe nommé diffusion de Mie. Puisque la lumière sera diffusée selon différents angles, dans ce cas la forme des particules doit être prise en compte dans la section efficace. La section efficace maximale est obtenu lorsque la taille de la particule est proche de la longueur d'onde incidente. La diffusion diminue de plus en plus que la différence entre la taille de la particule et la longueur d'onde augmente (c'est le cas de la spectrophotométrie moléculaire).
Applications
- Détermination d'une concentration inconnue
Connaissant le spectre d'absorption d'une espèce chimique, on peut mesurer, à l'une de ses longueurs d'onde 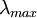 (à l'endroit où l'absorption est maximale) les variations de l'intensité
(à l'endroit où l'absorption est maximale) les variations de l'intensité 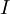 d'un faisceau lumineux traversant une même épaisseur
d'un faisceau lumineux traversant une même épaisseur 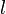 de solutions de concentrations diverses.
de solutions de concentrations diverses.
Ceci permet d'établir expérimentalement la courbe 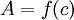 reliant l'absorbance et la concentration de la substance étudiée (avec
reliant l'absorbance et la concentration de la substance étudiée (avec 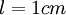 ), en effectuant les mesures de
), en effectuant les mesures de 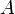 pour diverses concentrations. Cette courbe est une courbe d'étalonnage.
pour diverses concentrations. Cette courbe est une courbe d'étalonnage.
La courbe expérimentale d'étalonnage permet ensuite de déterminer la concentration inconnue d'une solution de cette substance par simple mesure de son absorbance et report sur le graphe 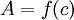 .
.
La loi de Lambert-Beer a des limites. Elle n'est linéaire que dans un intervalle de concentrations réduit comprenant des valeurs inférieures à 10-2mol. l-1.
- Suivi de la cinétique d'une réaction chimique
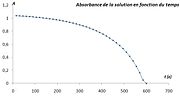
Quand au cours d'une réaction chimique dont on veut étudier la cinétique de l'une des espèces chimique en solution, on peut par spectrophotométrie d'absorption suivre la concentration de cette espèce (généralement colorée). Si cette espèce est un réactif, l'absorbance de la solution diminue au cours du temps. Si au contraire, c'est un produit de la réaction, l'absorbance de la solution augmente au cours du temps.
Exemples
- On peut suivre la cinétique de la réaction d'oxydo-réduction en milieu acide, entre l'acide oxalique C2H2O4 par l'ion permanganate MnO4- (couleur violette) par la mesure de la diminution d'absorbance de ce dernier pour la longueur d'onde λ = 540 nm.
Voir aussi
Références
James HENKEL, Essentials of drug product quality (p 130, 133). 1978, The Mosby Company, (ISBN 0801600316) .
Liens externes
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 13/04/2009.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.


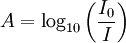
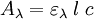
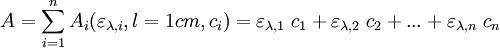
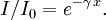
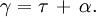
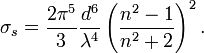

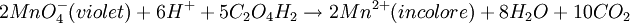

 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité