Spectrométrie d'absorption
La spectrométrie d'absorption est une méthode physique d'analyse chimique. Elle s'utilise essentiellement sur les liquides.
Recherche sur Google Images :

Source image : www.lca.be Cette image est un résultat de recherche de Google Image. Elle est peut-être réduite par rapport à l'originale et/ou protégée par des droits d'auteur. |
Page(s) en rapport avec ce sujet :
- Réaction des produits de combustion partielle avec l'air... Retour au niveau essentiel et émission d'un photon de longueur d'onde caractéristique de l'atome... Éléments analysables en spectroscopie d'absorption atomique... (source : moodle.insa-rouen)
- En spectroscopie d'absorption ultraviolette et visible, les unités les plus utilisées pour les longueurs d'onde sont les millimicrons mµ ou nanomètres nm (... (source : ensa-agadir.ac)
- ... Spectres d'absorption des Chlorophylles dans l'ether... Par conséquent il faut rester prudent lorsque on identifie un produit par comparaison avec un... pour une longueur d'onde fixée, le plus souvent pour le maximum d'absorption, ... (source : formation.etud.u-psud)
La spectrométrie d'absorption est une méthode physique d'analyse chimique. Elle s'utilise essentiellement sur les liquides.
La couleur d'un corps en transmission (transparence) représente sa capacité à absorber certaines longueurs d'onde. L'absorption d'une longueur d'onde λ par un produit est modélisée par la loi de Beer-Lambert :
où
- I0 est l'intensité incidente de la radiation λ, et I est l'intensité sortante ;
- µ est le cœfficient d'absorption, qui dépend du produit et de λ ;
- ρ est la masse volumique du produit ;
- x est le chemin parcouru dans le produit.
Analyse qualitative
Connaissant la densité d d'un produit et le chemin x parcouru par la lumière, si on mesure l'intensité sortant du produit, on peut déterminer le cœfficient d'absorption pour la longueur d'onde reconnue.
Les pics d'absorption (maxima de µ) correspondent à des transition électroniques (quantifiées), et sont par conséquent caractéristiques de la nature des atomes et de leurs liaisons chimiques.
Ceci sert à reconnaître la nature chimique de certains produits. C'est surtout l'absorption de longueurs d'onde données de la lumière solaire qui a permis de découvrir que le Soleil était entouré de gaz, ce qui amena à la découverte de l'hélium.
Analyse quantitative
Supposons qu'on ait
- un produit 1 ayant un cœfficient d'absorption µ1 particulièrement important pour une longueur d'onde λ1 et négligeable pour λ2 ;
- un produit 2 ayant à l'inverse un cœfficient µ2 d'absorption négligeable pour λ1 mais particulièrement important pour λ2 ;
alors, pour un mélange des produits 1 et 2, avec une masse volumique respective ρ1 et ρ2, on aura :
La mesure des intensité respectives de λ1 et λ2 permet par conséquent de déterminer ρ1 et ρ2, et par conséquent de déterminer les proportions du mélange. Cela nécessite un étalonnage pour s'abstraire de l'intensité I0 (λ) et de l'absorption propre de l'appareil. On travaille généralement en rapport d'intensité :
soit
La seconde équation est celle donnant la masse volumique totale ρ :
- ρ = ρ1 + ρ2
En général, si on a un mélange de n produits ayant chacun un pic d'absorption caractéristique pour une longueur d'onde donnée λi, on a alors un dispositif de n équations à résoudre :
et
Application
Outre l'analyse chimique, on utilise cette méthode pour déterminer le pourcentage d'oxygénation du sang (oxymétrie) mais aussi le pouls.
Voir aussi
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 13/04/2009.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.

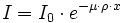
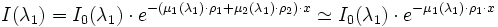
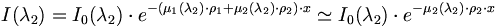
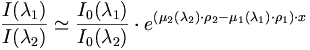
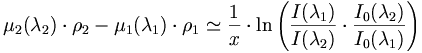
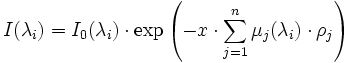
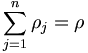

 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité